- Life
- Forschung
Meldung vom: | Verfasser/in: Maria Schulz/Axel Burchardt
Aktuelle Erkenntnisse aus einem Jena-Züricher Forschungsprojekt bilden eine wichtige Grundlage für die Erzeugung künstlicher Symbiosen mit gezielten Eigenschaften, die zukünftig für biotechnologische Anwendungen genutzt werden könnten. So könnten sie in der Medizin, Landwirtschaft oder Umwelttechnik eingesetzt werden, um Pflanzen gegen Krankheiten zu schützen oder Pilze so zu modifizieren, dass sie bestimmte Enzyme oder pharmazeutische Wirkstoffe herstellen.
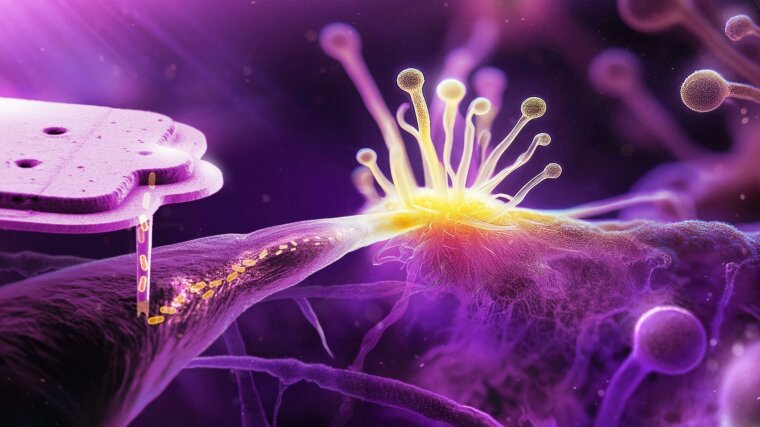
An dem interdisziplinären Projekt waren Forschende um Christian Hertweck, Professor an der Universität Jena und Abteilungsleiter am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut – Jena (Leibniz-HKI) und die Arbeitsgruppe um Julia Vorholt, Professorin für Mikrobiologie an der ETH Zürich beteiligt. Grundlage für die Studie war eine am Leibniz-HKI entdeckte natürliche Pilz-Bakterien-Symbiose.
Die Forschenden der ETH Zürich entwickelten eine innovative Methode zur präzisen Implantation von Bakterien in Pilzzellen und zeigten durch Evolutionsexperimente, wie sich die Symbiose stabilisieren lässt. Das Jenaer Team konzentrierte sich auf die chemische und mikrobiologische Analyse der Wechselbeziehung. Die Forschenden untersuchten, welche chemischen Substanzen durch das eingebrachte Bakterium in seinem neuen Pilzwirt produziert werden. Das Projekt bereichert auch den Exzellenzcluster „Balance of the Microverse“, in dem die Bildung und das Gleichgewicht mikrobieller Gemeinschaften erforscht werden.
Außergewöhnliche Wohngemeinschaften und Eindringlinge
In der Studie wurden zwei verschiedene Bakterienarten in die Zellen des Pilzes Rhizopus microsporus injiziert: Escherichia coli und Mycetohabitans rhizoxinica. Während E. coli eine rasche Abwehrreaktion des Pilzes hervorrief, schafften es die Bakterien der Gattung Mycetohabitans, sich in den Pilzzellen einzunisten und sogar in die Sporen zu gelangen. Das ist ein entscheidender Schritt, um an die nächste Pilzgeneration weitergegeben zu werden.
Anfangs keimten die infizierten Sporen weniger häufig und die neuen Pilze wuchsen langsamer. Durch die gezielte Auswahl jener Pilze, die erfolgreich Bakterien an die Nachkommen weitergaben, konnte sich der Pilz erholen. Über mehrere Generationen passten sich die Partner einander an und optimierten ihre Zusammenarbeit. Die Forschenden fanden zudem heraus, dass der Gast zusammen mit seinem Wirt biologisch aktive Moleküle produzierte, die den Wirt bei der Beschaffung von Nährstoffen und bei der Abwehr von Fressfeinden wie Fadenwürmern oder Amöben unterstützen könnten.
Fragile Systeme
In ihrer Studie konnten die Forschenden zeigen, wie fragil frühe endosymbiotische Systeme sind. „Damit neue Endosymbiosen entstehen und sich stabilisieren, braucht es einen Vorteil für das Zusammenleben“, betont Julia Vorholt. Voraussetzung dafür ist, dass der Gast Eigenschaften mitbringt, die die Endosymbiose begünstigen. Für den Wirt ist es eine Chance, sich auf einen Schlag durch das Einverleiben eines anderen Organismus neue Merkmale anzueignen, auch wenn es Anpassungen braucht.
Original-Publikation:
Giger GH et al. (2024): Inducing novel endosymbioses by implanting bacteria in fungi. Nature. https://doi.org/10.1038/s41586-024-08010-xExterner Link
Beutenbergstraße 11a
07745 Jena Google Maps – LageplanExterner Link